放弃14.8万股后 “差异化”路线能否让迪哲医药(688192SH)看到机会?
来源:智通财经网
创新医药行业、芯片行业、高端制造业都是值得长期关注的行业,科技创新板的推出也为这些行业的新兴企业上市融资提供了便利。12月10日,迪哲医药(688192。SH)成功登陆上海证券交易所科技创新板,募集资金总额20.9亿元。
然而,上市当天,迪哲药业并没有受到投资者的好评。开盘价报45元,较发行价(52.58元)下跌13.85%,成为11月17日以来首只上市首日破发的新股。截至12月10日收盘,迪哲药业报每股41.10元,较发行价下跌21.83%。以收盘价计算,地哲医药市值为164.4亿元。
智通财经APP显示,地哲医药是按照科创板第五套上市标准上市的。第五套上市标准是专门为不盈利的高科技企业制定的。其中,对不盈利医药公司的要求是:预计市值不低于40亿元人民币,主营业务或产品需经国家有关部门批准,市场空间大。至少需要有一个医药工业企业的核心产品被批准进行II期临床试验。
目前没有新药上市,研发费用超过4亿元。
从2017年10月正式成立到2021年12月在科技创新板成功IPO,迪哲医药仅用了4年时间,增速惊人。招股书显示,公司目前的战略重点是恶性肿瘤、免疫性疾病等重大疾病,这些疾病有巨大的未得到满足的刚性治疗需求。
截至2021年6月30日,迪哲药业的R&D管道组合拥有4个处于临床阶段并用于多个适应症的创新药物,以及多个处于临床前研究阶段的候选创新药物,其中2个产品处于关键临床阶段,多个候选创新药物处于临床前研究阶段。值得注意的是,迪哲医药目前管道组合中的所有产品均享有完整的全球权益,采用全球同步开发的模式。
据智通财经APP了解,一个新药的研发已经进入临床研究阶段,一般分为一期、二期、三期临床试验。临床试验完成后,如果试验结果符合预期,确认药品的安全性和有效性,且已达到药品的GMP生产条件,药品企业可向药品监管部门提出药品上市申请。新药上市申请经药品监督管理部门批准后,新药方可上市。
德哲药业目前没有上市产品,只有4个创新药处于临床阶段,研发进度最快的药物也仅处于II期单臂关键试验阶段。预计药品最早要到2023年才能上市,整体进度比较早。
报告期内,公司投入大量资金进行产品管道的临床前研究和临床试验。2018年至2021年上半年,公司R&D费用分别为2.1亿元、4.21亿元、4.39亿元和2.58亿元。不断增加的R&D费用是其不断推出首批药物的关键因素。
研究中的核心产品DZD4205是从阿斯利康转移过来的。它的竞争力如何?
招股书显示,地哲医药处于临床阶段的4个药物分别为治疗血液肿瘤疾病的DZD4205、非小细胞肺癌小分子靶向药物DZD9008、有效抑制HER2乳腺癌细胞增殖的DZD1516、高选择性腺苷A2a受体拮抗剂DZD2269,适应症为转移性去势抵抗性前列腺癌(mCRPC)。因为后两种药物还在I期临床试验,预计2022年进入II期临床试验,上市时间无法估计。因此,迪哲医药的短期增长取决于DZD4205和的竞争力
根据临床要求,淋巴瘤起源于淋巴结和淋巴组织,是一种免疫系统的恶性肿瘤。根据组织病理学改变,淋巴瘤可分为两类:霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL),其中NHL约占所有淋巴瘤的90%。
外周T细胞淋巴瘤(PTCL)是一种异质性且通常具有侵袭性的非霍奇金淋巴瘤(NHL),占世界所有NHL病例的7%。PTCL在中国的发病率明显高于欧美,约占NHL的25%。根据Jost Sullivan的分析,2019年全球外周T细胞淋巴瘤新增病例约3.6万例,预计2024年患者人数将增至4.1万例,年复合增长率为2.3%。
然而,PTCL患者在初始缓解后仍有很高的复发风险。目前,批准用于治疗复发和难治性PTCL的药物主要是HDAC抑制剂,包括Romidepsin、beristain和chidamide。国内市场只批准了奇达美(科技创新板上市公司微芯生物的创新药),其客观缓解率为28%。除了HDAC抑制剂,其他被批准用于复发和难治性PTCL的药物是Pralatrexat,一种在美国和中国上市的叶酸拮抗剂。因此,临床上迫切需要开发出有效的治疗复发性和难治性PTCL的方法。目前的临床试验数据显示,DZD4205的客观缓解率为51.9%,表现出良好的安全性和耐受性。
更重要的是,DZD4205对JAK1靶标具有高度选择性,但对其他JAK家族蛋白的抑制能力较弱,且具有良好的潜在安全性,因此有望成为JAK抑制剂领域的有力竞争者。JAK靶向药物方面,截至2021年8月31日,全球共有7种药物上市,分别是Abbey的Gilead Filgotinib、Upadacitinib、Anstalai Pharmaceutical的Peficitinib、Japan Tobacco的Delgocitinib乳膏、Lilly和Insight Medical联合开发的Barritinib、Novartis的Lucotinib和Pfizer的Tofatib,其中后三种药物已获准在中国上市。此外,世界上有9种JAK靶向药物正在研究中,其中从适应症来看,只有迪特、吉列和Insight是针对癌症的。所以从这个角度来说,DZD4205还是有竞争力的。
2019年,全球JAK1抑制剂市场规模约为55亿美元,2019年至2024年和2024年至2030年的年复合增长率分别为28.4%和8.0%。中国市场规模为4亿元,预计2019-2024年和2024-2030年的年复合增长率分别为92.2%和30.0%,明显快于全球增速。JAK1抑制剂在中国的市场规模虽然不大,但是增长速度比较快,是一个快速增长的带。德哲医药有望凭借DZD4205享受行业发展红利。
此外,基于DZD4205在免疫疾病领域的潜在优势,德哲医药还在研发眼疾(干眼症)滴眼液、皮肤病(特应性皮炎)软膏等局部使用的特殊制剂,以最大化产品的价值潜力。
自主研发产品DZD9008,优秀的临床数据。
招股书显示,地哲医药的另一核心研发产品为DZD9008,为公司自主研发的非小细胞肺癌小分子靶向药物。目前正处于二期单臂试验的关键阶段,预计2023年在美国FDA、中国NMPA等国家和地区提交上市申请。
众所周知,肺癌分为很多类型,其中非小细胞肺癌(NSCLC)约占85%。在所有的非小细胞肺癌中,最常见的三种突变发生在表皮生长因子受体(EGFR)、克斯坦鼠肉瘤病毒癌基因同系物(KRAS)和间变性淋巴制造酶(ALK),约占所有非小细胞肺癌患者的72%(EGFR突变在亚洲患者中尤为常见)。
目前已批准上市的第一、二、三代EGFR-TKI(代表药物分别为吉非替尼、阿法替尼和奥昔替尼)对EGFR敏感突变即外显子19缺失和外显子21 L858R突变的非小细胞肺癌有较好疗效,第三代EGFR-TKI对EGFR T790M耐药突变也有效。
而上述药物对外显子20插入突变无明显作用。截至2021年8月31日,国内尚无小分子靶向药物获批该适应症。因此,DZD9008有望成为具有EGFR/HER2 20外显子插入突变的实体瘤未满足治疗需求领域的有力竞争者。
据智通财经APP显示,截至2021年8月31日,全球针对非小细胞肺癌EGFR/HER2 20外显子插入突变适应症研发的产品有6个,其中5个为EGFR TKI,1个为EGFR/c MET双特异性抗体。其中,强生和武田制药的产品已经获得有条件批准,是迪哲药业在该制药领域的竞争对手。不过德哲的这个DZD9008也不是没有优势。由于其出色的临床数据,公司已于2020年12月获得中国CDE“突破疗法药物品种”资格,预计将于2021年第四季度向FDA提交突破疗法指定申请。
从行业前景来看,2019年EGFR TKIs药物全球市场规模约为53亿美元,预计2019年至2024年和2024年至2030年的年复合增长率分别为18.1%和11.2%。中国市场规模为77亿元,2019年至2024年复合年增长率分别为32.4%,2024年至2030年复合年增长率为11.6%。近几年的增速明显快于全球增速。EGFR TKIs药物在国内的市场规模相对客观,德哲医药的DZD9008具有比较优势,未来有望在市场上占据一席之地。
不可否认的是,德哲医药在研药物的适应症基本属于大癌种中占比相对较小的一些子类别,市场空间不是很大,但也体现了差异化竞争路线,具有一定的亮点。此外,地哲医药在招股书中表示,“真正了解未被满足的临床需求,并能够将临床需求转化为药物特性,筛选和开发满足药物特性所需的化合物,是地哲医药的独特竞争力。”
随着全球癌症患者的日益增多,以及抗肿瘤药物市场年复合增长率的逐年攀升,即使对于现有上市产品的标的来说,如果地哲医药真的能找到合适的临床需求,也有非常可观的市场空间。

-
鼓楼中国人寿携手光大银行华林分行推出“欢乐元宵·兔年元宵·祝福”客户联谊活动
2024-05-09
-
证监会对黄有龙赵薇孔德永分别采取5年证券市场禁入措施
2024-05-09
-
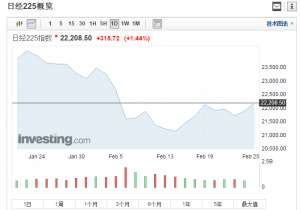
日韩股市周一双双高开 日经225指数涨幅扩大至1.44%
2024-05-09

-
量学扛鼎之作《股市天经:量波逮涨停》横空出世
2024-05-09

-
B站周三纳斯达克挂牌 一路下跌至2.26% 市值约31亿美元
2024-05-09
-
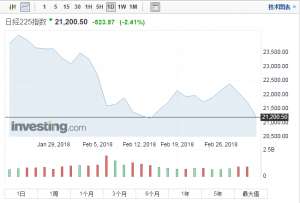
亚太股市继续走低,日本股市早盘大跌2% 东证股价指数开盘下跌1.65%
2024-05-09
