恒瑞药业BD产品中美上市失败专家-或对2亿元首付计提减值准备
(原标题:恒瑞医药BD产品中美上市失败。专家:首付2亿元或应计提减值准备)
财联社3月10日电(记者王俊贤陆阿峰)恒瑞医药曾被视为重仓BD交易的操作,如今遭遇尴尬局面。普那布林申请中美上市失败,恒瑞药业公告称“目前没有该产品的后续研发计划”。对此,有财税专家向财联社记者分析,如果该药被宣布彻底失败,公司应该对2亿元首付款全额计提减值准备。
3月10日晚间,恒瑞药业发布公告称,大连万春母公司近日收到中国美国食品药品监督管理局的药品通报,普那布林新药上市申请未获通过。其特殊适应症是与聚乙二醇化重组人粒细胞刺激因子联合使用,治疗成人非髓系恶性肿瘤化疗引起的中性粒细胞减少症(CIN)。
数据显示普那布林是一种新的合成化学实体。普那布林作为“一流”的免疫抗肿瘤药物,可通过激活免疫防御蛋白鸟嘌呤核苷酸交换因子(GEF-H1)加速树突状细胞(DC细胞)的成熟和促进抗原提呈,并直接激活T细胞杀伤肿瘤细胞,从而起到“免疫系统点火器”的作用。此外,普那布林还可以预防化疗药物诱导的骨髓中性粒细胞损伤,实现早期保护,以不同于G-CSF的机制预防早期CIN。
2020年9月,普那布林被中美药品监管机构认定为CIN预防领域的“突破性疗法”。2021年,普那布林的CIN适应症NDA申请被美国和中国接受,并被授予“优先审查”资格。2021年8月25日,恒瑞医药与大连万春签署协议,拟以自筹资金投资大连万春,取得普那布林在大中华区的联合开发和独家商业化权益。
当时,恒瑞医药在普那布林的牌照被认为是公司引进管道的一次重磅操作。
然而随之而来的是,中美都失败了。
2021年12月,万春医药收到FDA的完整回复(CRL),普那布林的上市申请被驳回。FDA在审查意见中指出,仅一项注册临床研究的数据不足以完全证实普那布林的临床价值。需要进行第二次对照注册临床研究,以提供足够的证据支持NDA;化疗引起的中性粒细胞减少症的预防:根据目前的数据,FDA不能批准NDA。
当时业界并不看好普那布林,现在普那布林中国的上市申请也没有获批。
对此,恒瑞医药在公告中表示,根据《普那布林产品合作协议》,公司已向大连万春支付2亿元,公司未对普那布林进行任何临床研究。关于《增资入股协议》中约定的对大连万春的股权投资1亿元,公司尚未支付,股权尚未交付。该产品目前没有后续研发计划。
著名财税评审专家、江苏四维咨询集团首席顾问刘志庚对财联社记者表示,根据目前公司公告中不明确的措辞,如果公司对已支付2亿元首的相关药物不再进行研发或取消上市计划,进而宣布该药物研发和上市彻底失败,公司的2亿元首支付应作为亏损处理,并相应全额计提减值准备。
海南博奥医疗科技股份有限公司总经理邓志东向财联社记者分析,普那布林在中美上市失败,主要原因是临床有效性不足。更糟糕的是,投资方恒瑞医药表示将停止后续投资和研发计划,这意味着其拥有了basica
-
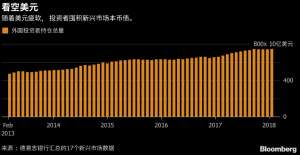
发展中国家本币债券的外国投资者持有量接近创纪录的7450亿美元
2024-05-09
-
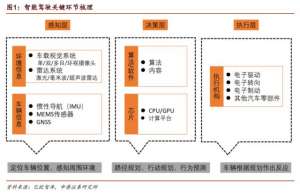
深圳官宣!无人驾驶商业化运营来了:概念股疯涨 揭秘关键环节投资机会
2023-06-20

-
率长江,被查!
2023-06-20

-
比尔·盖茨的中国往事
2023-06-20
-
刚刚!国务院,利好来了!
2023-06-20

-
历史最卷一届618:混乱中,理性回归
2023-06-20
